Warum sollten Sie uns wählen?
Vertrauen
Vertrauen ist einer unserer wichtigsten Werte. Deshalb legen wir großen Wert auf die Sicherheit Ihrer Daten und tauschen diese nur über sichere Server in Deutschland mit Ihnen aus.
Kundenzufriedenheit
Ihre Zufriedenheit ist unser höchstes Ziel in allen Projekten. Ein Projekt ist für uns nur dann erfolgreich, wenn Sie zufrieden sind!
Zuverlässigkeit
Müssen Sie kurzfristig ein kritisches Problem lösen? Gemeinsam können wir das schaffen - wenn nötig auch mit einer Nachtschicht. Denn wir sind immer für unsere Kunden da.
Vier Gründe für unsere Zusammenarbeit
- Sie profitieren von unserer jahrelangen Erfahrung in den Gebieten QM und MDSAP.
- Wir begleiten Sie von der MDSAP Vorbereitung, durch das Audit bis zur Nachbereitung.
- Ihr Projekterfolg wird durch unsere Experten gesichert.
- Ihre Zufriedenheit ist unser wichtigstes Ziel.
Vertrauen und Zuverlässigkeit sind eine wichtige Basis im Projekt. Unsere Experten geben Ihren Mitarbeitern die nötige Unterstützung und Sicherheit, damit alle Beteiligten ihr volles Potential entfalten können.
Das erfolgreich zu bestehende MDSAP Audit und Ihre Zufriedenheit sind unser Kompass!

Unsere Dienstleistungen
thinqbetter bietet MDSAP Unterstützung in allen Projektphasen.
Ob Schulung, Gap Analyse oder Unterstützung bei der Anpassung von Prozessen: Wir sind für Sie da!
Unsere Experten begleiten Sie auf Wunsch auch durch das Audit.
Abweichungen kommen vor, insbesondere im initialen MDSAP Audit. Wir schließen diese mit Ihnen.
Was ist MDSAP?
MDSAP steht für „Medical Device Single Audit Program“ – Also ein Programm, mit dem die länderspezifischen Anforderungen der Mitglieder überprüft werden. Aktuell gibt es 5 teilnehmende Regulierungsbehörden.
Es gibt das sogenannte Companion Document, in dem die MDSAP Anforderungen gelistet sind. Sortiert sind diese entsprechend der wichtigsten Hauptprozesse, die MDSAP identifiziert:
- Chapter 1 Process: Management
- Chapter 2 Process: Device Marketing Authorization and Facility Registration
- Chapter 3 Process: Measurement, Analysis and Improvement
- Chapter 4 Process: Medical Device Adverse Events and Advisory Notices Reporting
- Chapter 5 Process: Design and Development
- Chapter 6 Process: Production and Service Controls
- Chapter 7 Process: Purchasing
Das Companion Document beschreibt nicht nur die einzelnen Anforderungen, es enthält auch Erklärungen und Verknüpfungen zwischen den einzelnen Tasks. Dadurch gibt es einen guten Überblick darüber, was im MDSAP Audit abgeprüft und erwartet wird.
Wie läuft ein MDSAP Audit ab?
Das wird sehr detailliert im Audit Model beschrieben. Das initiale Audit teilt sich in zwei Stages.
Stage 1 umfasst eine Prüfung des Qualitätsmanagementsystems per remote. An dieser Stelle wird geprüft, ob das Unternehmen bzw. das QMS bereit für Stage 2 ist. Sollten Abweichungen auftreten, werden diese von der auditierenden Organisation vor dem Beginn von Stage 2 kommuniziert.
Stage 2 ist das Audit vor Ort beim Hersteller, in dem tiefergehend geprüft wird, ob alle Anforderungen eingehalten werden.
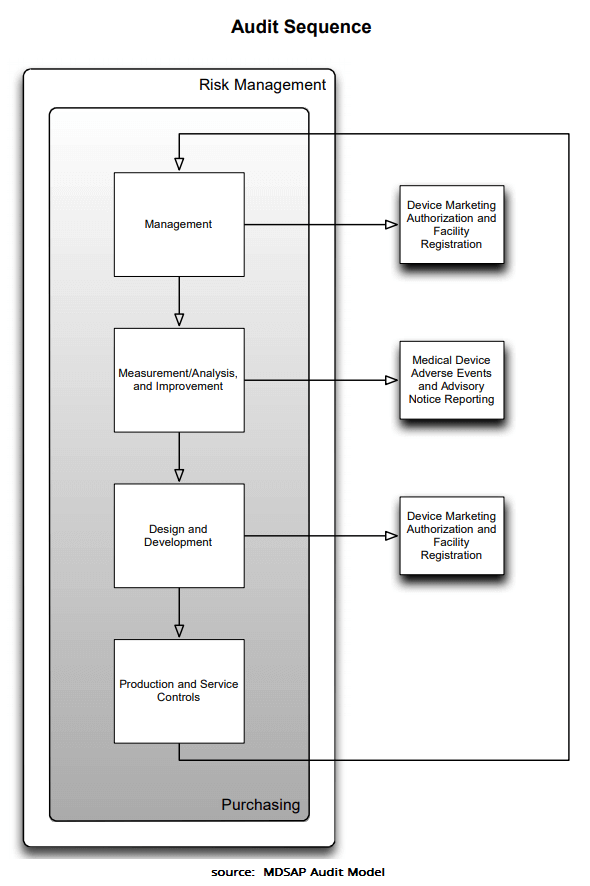
Im Audit wird entsprechend der „Audit Sequence“ vorgegangen. Diese ist in der Grafik rechts zu sehen. Dort geht klar hervor, wie sehr das Risikomanagement und Beschaffung im Fokus stehen.
Welche MDSAP Mitglieder gibt es?
- ANVISA – Brazil’s Agência Nacional de Vigilância Sanitária
- FDA – U.S. Food and Drug Administration
- HC – Health Canada
- MHLW – Japan’s Ministry of Health, Labour and Welfare, and the Japanese Pharmaceuticals and Medical Devices Agency
- TGA – Therapeutic Goods Administration of Australia
Neben den gelisteten „vollwertigen“ Mitgliedern gibt es noch die sog. „Affiliate Members“.
Was ist ein MDSAP Affiliate Member?
Die Definition des Affiliate Members beschreibt folgendes: „A non-participating MDSAP Observer or non-participating MDSAP RAC regulatory authority that wants to engage in MDSAP, demonstrates understanding of MDSAP and utilize MDSAP audit reports and/or MDSAP certificates for evaluating a medical device manufacturer’s quality management system.“
Die Abkürzung RAC steht dabei für „Regulatory Authority Council“. Das RAC besteht aus Vertretern aller MDSAP Mitglieder (Australien, Brasilien, Japan, Kanada, USA) und bietet Anleitung, Aufsicht und Ressourcen zur Unterstützung der Entwicklung, Implementierung, Wartung und Erweiterung des MDSAP.
Wie steht die Europäische Union zu MDSAP?
Die EU ist ein „MDSAP Official Observer“. Das beschreibt Regulierungsbehörden bzw. potentielle Mitglieder, die sich eventuell für eine Teilnahme am MDSAP entscheiden und aktive Mitglieder werden. Grundsätzlich ist es so, dass die Einführung der MDR und IVDR den Grundstein für die Teilnahme der EU an MDSAP legt. Zuvor hätten alle spezifischen Länderanforderungen der EU Mitglieder mit abgedeckt werden müssen. Verständlicherweise hätte das zu einem enormen Aufwand für die Einhaltung der EU-Anforderungen geführt. Jetzt gelten durch die MDR und IVDR einheitliche Anforderungen in Europa und bietet somit eine realistische Grundlage für die MDSAP Teilnehme.
Als Observer / Beobachter kann die EU an Sitzungen, Bewertungen und anderen Aktivitäten der MDSAP Meetings teilnehmen.
Warum sollten Sie uns wählen?
Vertrauen
Vertrauen ist einer unserer wichtigsten Werte. Deshalb legen wir großen Wert auf die Sicherheit Ihrer Daten und tauschen diese nur über sichere Server in Deutschland mit Ihnen aus.
Kundenzufriedenheit
Ihre Zufriedenheit ist unser höchstes Ziel in allen Projekten. Ein Projekt ist für uns nur dann erfolgreich, wenn Sie zufrieden sind!
Zuverlässigkeit
Müssen Sie kurzfristig ein kritisches Problem lösen? Gemeinsam können wir das schaffen - wenn nötig auch mit einer Nachtschicht. Denn wir sind immer für unsere Kunden da.
Infos
anfordern
Einer unserer Berater wird Sie kurz nach Erhalt Ihrer Anfrage kontaktieren.
Vertraulichkeit und Diskretion sind für uns wichtig. Daher werden wir Ihre Anfrage entsprechend behandeln, auch bevor wir eine Vertraulichkeitsvereinbarung abschließen.
